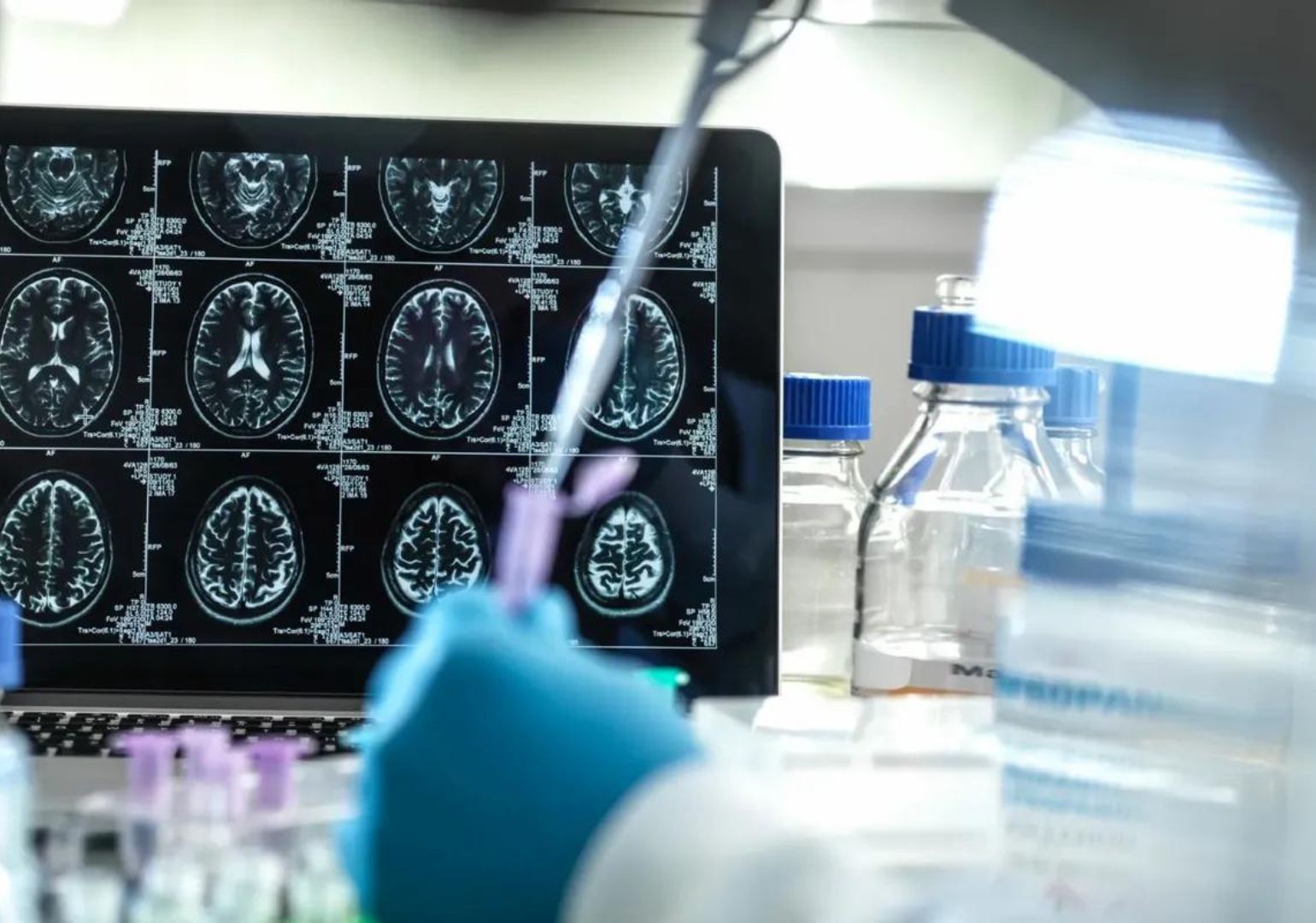
6 ივლისს ალცჰაიმერის სამკურნალო წამალმა Leqembi-მ აშშ-ის საკვებისა და მედიკამენტების მარეგულირებელი სააგენტოსგან სრული ავტორიზაცია მიიღო. ამ გადაწყვეტილების საფუძველზე აშშ-ში აღნიშნული წამალი ქრონიკული ნეიროდეგენერაციული დაავადების სამკურნალო სქემებსა და სადაზღვევო პაკეტებში ჩაერთვება.
Leqembi პირველი პრეპარატია, რომელმაც მკურნალობის კურსში ჩართვის შემდეგ პაციენტებში დაავადების შედეგად გამოწვეული კოგნიტიური დაქვეითება შეანელა.
ცნობისთვის, წამლის იაპონურმა მწარმოებელმა, Eisai-მ პირობითი თანხმობა FDA-სგან მიმდინარე წლის იანვარში მიიღო. პირველადი სამედიცინო კვლევების შედეგები FDA-მ 1,800 პაციენტისგან შემდგარ კვლევაში დაადასტურა. მარეგულირებლის ცნობით, აღნიშნული წამლით მკურნალობის შედეგად პაციენტებში მეხსიერების დაკარგვის პროცესი დაახლოებით 5 თვით შენელდა.
„ამ კვლევამ დაადასტურა, რომ აღნიშნული წამალი ალცჰაიმერით დაავადებულ პირთა მკურნალობისთვის უსაფრთხო და ეფექტიანია,“ — განაცხადა FDA-ის ნევროლოგიური წამლების დეპარტამენტის დირექტორმა, ტერეზა ბურაჩიომ.
ამ ეტაპზე მკურნალობის ერთწლიანი კურსისთვის საჭირო მედიკამენტის ღირებულება დაახლოებით $26,500-ია.
შეგახსენებთ, აშშ-ის სახელმწიფო სადაზღვევო პროგრამის წარმომადგენლები 2022 წლის იანვარში აცხადებდნენ, რომ ალცჰაიმერის სამკურნალო წამლის ხარჯებს სადაზღვევო პროგრამა მხოლოდ იმ შემთხვევაში დაფარავდა, თუ იგი FDA-ის სრულ ავტორიზაციას მიიღებდა.
როგორც ცნობილია, Eisai-მ ინვესტორებს უკუგებასთან დაკავშირებული პროგნოზებიც გაუზიარა. კომპანიის შეფასებით, 2026 წლისთვის აშშ-ში შესაძლოა 100,000-მდე ადამიანს ჰქონდეს დიაგნოზი, რომელიც Leqembi-თ მკურნალობას ექვემდებარება.
აშშ-ის ბაზრისთვის წამალს იაპონური Eisai და ამერიკული ბიოტექნოლოგიური კომპანია Biogen-ი დაამზადებენ.
Forbes Georgia: სარედაქციო გუნდი