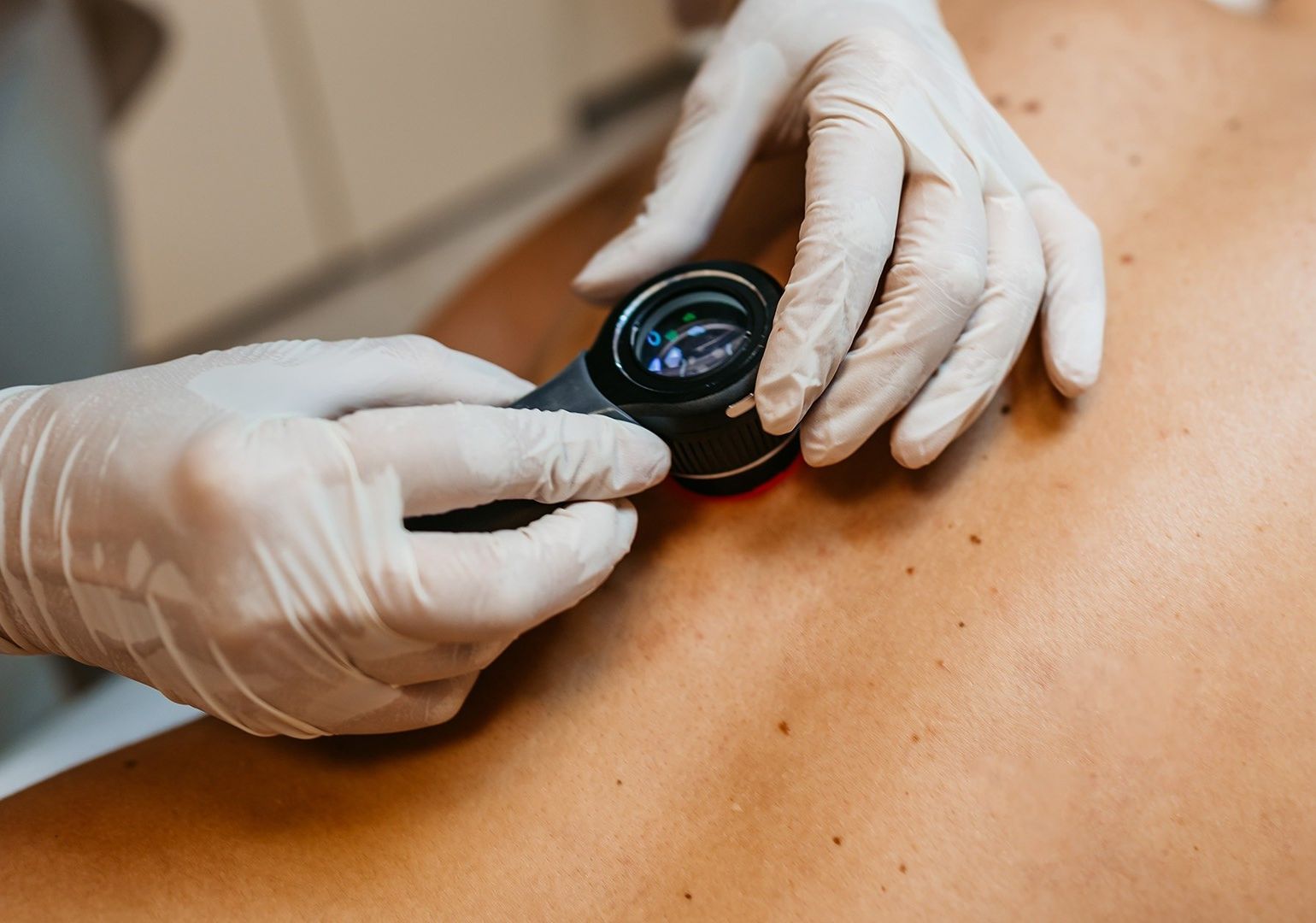
ამერიკის შეერთებული შტატების სურსათისა და მედიკამენტების ხარისხის კონტროლის სააგენტომ (FDA), დაავადების გავრცელებულ სტადიაზე მყოფი ორი სახის მელანომისთვის ინოვაციური, უჯრედოვანი მკურნალობა დაამტკიცა. აღნიშნული განკუთვნილია კანის კიბოს მქონე ზრდასრული პაციენტებისთვის, რომელთაც უკვე სცადეს სხვადასხვა ტიპის მკურნალობა სიმსივნის ზრდის წინააღმდეგ საბრძოლველად.
უჯრედოვანი მკურნალობა, სახელწოდებით – Amtagvi, კალიფორნიაში დაფუძნებული ორგანიზაცია Iovance Biotherapeutics-ის მიერაა შემუშავებული. Amtagvi განკუთვნილია მეტასტაზური მელანომით დაავადებული პაციენტების სამკურნალოდ, რომელთა მდგომარეობაც სხვადასხვა სახის წამლების მიღების შემდეგ – როგორიცაა, მაგალითად, იმუნოთერაპია PD-1 მაბლოკირებელი ანტისხეულით – არ გაუმჯობესებულა.
FDA-ს მიერ დამტკიცებული მკურნალობა შეეხება პაციენტებს, რომელთა მელანომაც ან გავრცელდა, ან მეტასტაზური გახდა, ან მისი მოცილება ქირურგიული ჩარევითაც ვერ მოხერხდა. ამ უკანასკნელს არარეზექტირებად მელანომად მოიხსენიებენ.
თერაპია ადამიანის იმუნური უჯრედების გამოყენებით მუშაობს. ექიმები პაციენტის სიმსივნიდან ქსოვილს იღებენ, შემდეგ მის იმუნურ უჯრედს და ლაბორატორიაში ზრდიან. საკმარისი იმუნური უჯრედების მიღების შემდეგ, ექიმები მას ინფუზიის სახით, კიბოსთან საბრძოლველად, პაციენტის ორგანიზმში აბრუნებენ.
მკურნალობა FDA-მ დაჩქარებული გზით დაამტკიცა – პროცესი, რომლის დროსაც სიცოცხლისთვის საშიში დაავადებებისთვის წამლის დამტკიცების დაჩქარება შესაძლებელია. Amtagvi-ის ცდებში, 73 პაციენტიდან 31.5%-ს დადებითი მაჩვენებელი ჰქონდა. პაციენტთა დაახლოებით ნახევარს მკურნალობის მიღებიდან ექვს, ცხრა და თორმეტ თვეში დაავადების პროგრესირების ნიშნები არ აღენიშნებოდა.
დაავადებათა კონტროლისა და პრევენციის ცენტრის მონაცემებით, 2020 წელს მელანომით დაავადების 77,200-ზე მეტი ახალი შემთხვევა დაფიქსირდა, გარდაცვალების მაჩვენებელმა კი 8,200-ს მიაღწია.